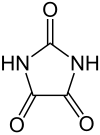
Parabansäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Parabansäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H2N2O3 | ||||||||||||||||||
| Kurzbeschreibung | farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | löslich in Alkohol und Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Parabansäure ist eine chemische Verbindung aus der Gruppe der Ureide.
Gewinnung und Darstellung
Parabansäure kann durch Reaktion von Harnstoff mit Diethyloxalat und anschließender Reaktion des daraus gewonnenen Zwischenproduktes mit Salzsäure gewonnen werden.[3] Ebenfalls möglich ist die Synthese durch Reaktion von Harnstoff und Oxalylchlorid oder neben Alloxan durch Oxidation von Harnsäure mit 30%igem Wasserstoffperoxid.[1]
Die Verbindung wurde erstmals 1838 durch Justus von Liebig und Friedrich Wöhler durch Einwirkung von Salpetersäure auf Harnsäure hergestellt.[4]
Eigenschaften
Parabansäure ist ein farbloser kristalliner Feststoff, der löslich in Alkohol und Wasser ist.[1] Sie ist eine zweibasische Säure, aber bildet fast nur saure instabile Salze.[4] Die Reduktion von Parabansäure führt zu Hydantoin (Imidazolidindion), das als aktive Methylen-Komponente in Kondensationsreaktionen eingesetzt wird (analog Erlenmeyer-Synthese).[1] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) und den Gitterparametern a = 10,684, b = 8,194, c = 5,044 Å, β = 92°30′ und vier Molekülen pro Zelle.[5]
Verwendung
Parabansäure wird als Zwischenprodukt zur Herstellung anderer chemischer Verbindungen (wie Pyridine) verwendet.[2] Es kann auch als (Co-)Monomer in Polymerisationen genutzt werden.[1]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Parabansäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. April 2021.
- ↑ a b c d e Datenblatt Parabansäure, 99% bei Sigma-Aldrich, abgerufen am 5. April 2021 (PDF).
- ↑ unbekannt: PARABANIC ACID. In: Organic Syntheses. 37, 1957, S. 71, doi:10.15227/orgsyn.037.0071.
- ↑ a b Ladenburg: Encyklopaedie der Naturwissenschaften. E. Trewendt, 1887, S. 40 (books.google.com).
- ↑ David R. Davies, J. J. Blum: Crystal Structure of Parabanic Acid. In: Nature. Band 173, Nr. 4412, 1954, S. 993–993, doi:10.1038/173993a0 (nature.com).





