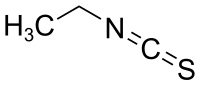
Ethylisothiocyanat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylisothiocyanat | ||||||||||||||||||
| Andere Namen |
Ethylsenföl | ||||||||||||||||||
| Summenformel | C3H5NS | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbe, klare Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 87,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,995 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
−6 °C[1] | ||||||||||||||||||
| Siedepunkt |
130–132 °C[1] | ||||||||||||||||||
| Löslichkeit |
7,02 g·l−1 bei 25 °C in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Ethylisothiocyanat ist eine chemische Verbindung aus der Gruppe der Isothiocyanate.
Vorkommen

Im Vergleich mit anderen Isothiocyanaten ist Ethylisothiocyanat in der Natur wenig verbreitet. Es kommt in den Samen der Virginischen Kresse vor.[3]
Gewinnung und Darstellung
Ethylisothiocyanat kann durch eine Hofmannsche Senfölreaktion von Ethylamin mit Kohlenstoffdisulfid und Quecksilber(II)-chlorid gewonnen werden.[4] Ebenfalls möglich ist die Darstellung durch Reaktion von N,N'-Diethylthioharnstoff mit Ethylamin.[5]
Verwendung
Ethylisothiocyanat kann zur Synthese von Heterocyclen dienen, beispielsweise von 2,3-Dihydropyridinen.[6]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Ethyl-isothiocyanat bei Sigma-Aldrich, abgerufen am 10. Juni 2023 (PDF).
- ↑ Eintrag zu Ethylisothiocyanat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Juni 2023. (JavaScript erforderlich)
- ↑ Anders Kjær, Ivan Larsen, Erling Tjus, R. H. Burris: isoThiocyanates. IX. The Occurrence of Ethyl isoThiocyanate in Nature. In: Acta Chemica Scandinavica. Band 8, 1954, S. 699–701, doi:10.3891/acta.chem.scand.08-0699.
- ↑ R. L. Madan: Organic Reactions Conversions Mechanisms & Problems. S. Chand Limited, 2009, ISBN 978-81-219-2038-4, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Henry Watts, George Fownes, Sir William Augustus Tilden: Watts' Manual of Chemistry, Theoretical and Practical. P. Blakiston, 1886, S. 114 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Lambert Brandsma, Nina A. Nedolya, Hermann D. Verkruijsse, Noel L. Owen, Li Du, Boris A. Trofimov: Synthesis of 2,3-dihydropyridines, cyclobutanopyrrolines and quinolines from lithiated allenes and isothiocyanates. In: Tetrahedron Letters. Band 38, Nr. 39, September 1997, S. 6905–6908, doi:10.1016/S0040-4039(97)01591-8.









